2025年4月30日,国际顶级期刊《Nature》在线发表了题为“A battery-free nanofluidic intracellular delivery patch for internal organs”的突破性研究成果,开发了一种全新设计的无电池纳米流体细胞内递送贴片(NanoFLUID),首次实现了深层器官高效、安全、精准的分子递送,为复杂疾病的机制研究和靶向治疗开辟了全新技术路径。我校Eye-X研究院特聘副研究员岳威为该研究的共同第一作者,蚌埠医科大学为共同第一作者单位。

在精准医疗迅速发展的今天,如何穿越体内多重生理屏障,将药物、基因或治疗因子精准输送至特定组织或器官,始终是困扰生物医学工程领域的关键难题。血管内皮的选择性通透性、细胞膜的生物物理屏障及器官微环境的异质性,使得现有递送技术面临递送效率低、靶向性差、副作用强等诸多挑战。数据显示,经静脉注射的纳米载体中,仅约2%的有效成分可到达目标部位,绝大多数被单核吞噬系统清除。病毒载体虽具备较高转染效率,但其引发的免疫反应及基因安全性问题,严重限制了临床转化。
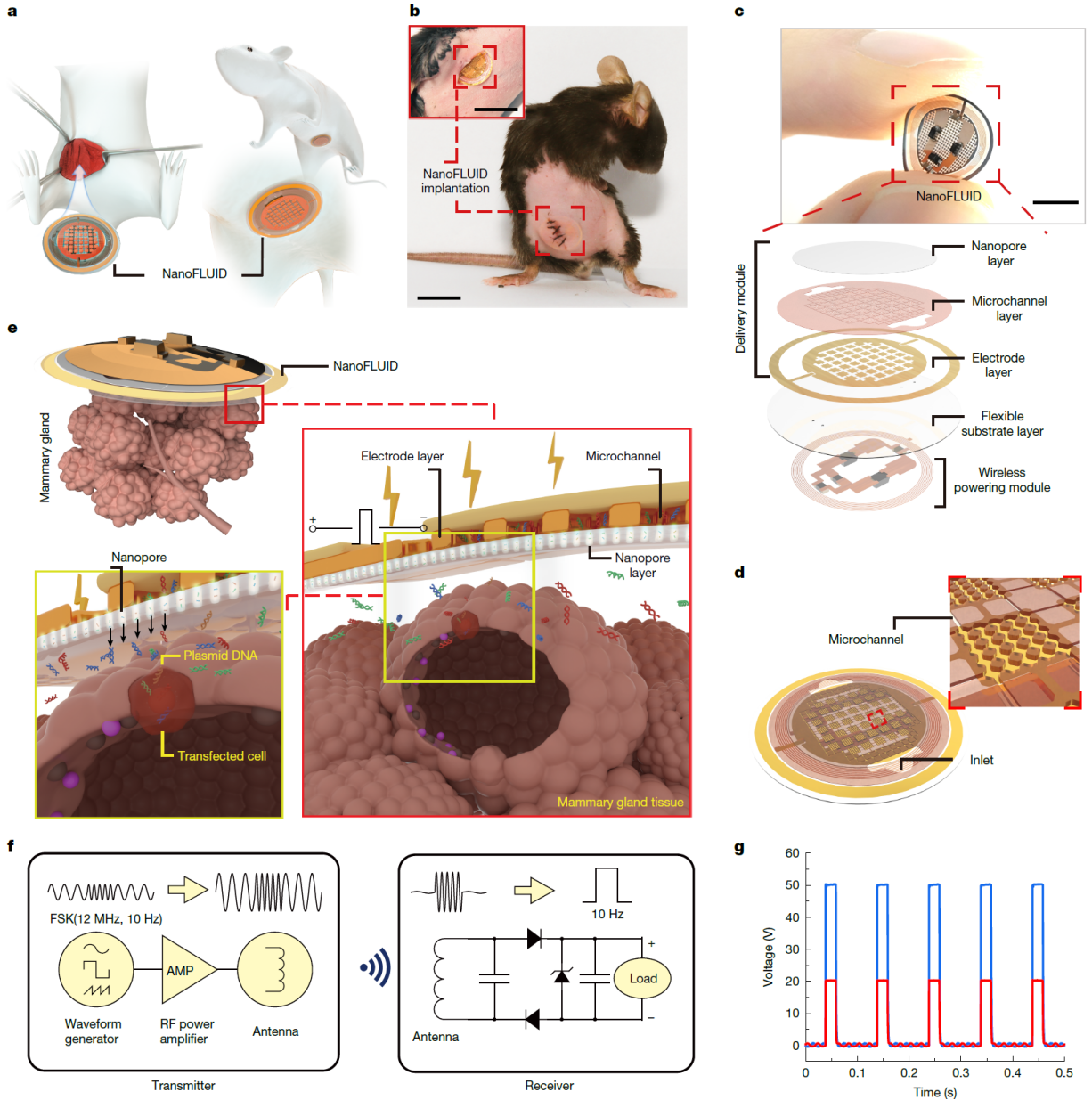
图1 NanoFLUID设计原理及工作机制
此项研究开发的NanoFLUID贴片突破性地采用柔性、低能耗结构设计,完美贴合如肝脏、乳腺等柔软器官表面,无需依赖电池或复杂芯片。核心结构集成纳米孔、微流通道与微电极系统,可在极低电压(约10V)下诱导可逆性电穿孔,使治疗分子在保持细胞活性的前提下快速进入胞内,实现细胞级、组织级精准操控。相比传统被动扩散方式,该技术的递送效率提升上万倍。
多种动物病理模型验证了该平台广泛的适应性和优越性能。在急性肝损伤模型中,NanoFLUID显著提高了修复因子的递送效率,明显加快了组织再生进程;在乳腺肿瘤模型中,贴片展现出良好的控毒性和肿瘤抑制效果,显著优于现有治疗手段。同时,其对细胞活性的影响低于5%,并可精确控制单个细胞的递送水平,彰显出卓越的生物安全性和可控性。
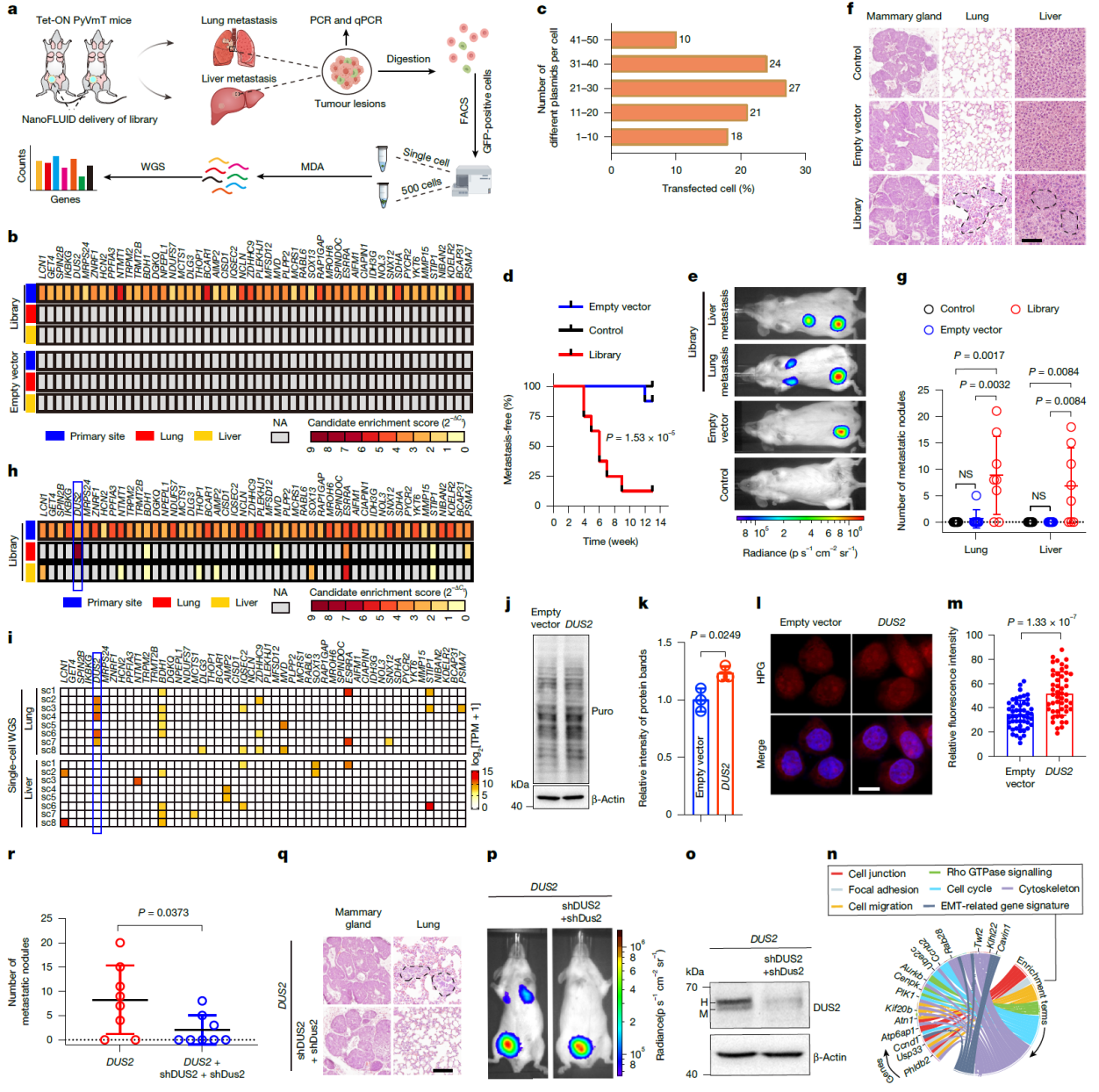
图2 NanoFLUID介导的肿瘤转移相关基因高通量筛选及靶向治疗
更具前瞻性意义的是,研究团队基于NanoFLUID平台,首次实现了活体条件下的大规模基因文库共转染筛选。结合高通量测序与系统生物学分析,发现并验证乳腺癌肺转移的关键驱动因子—DUS2。该基因通过提升多种转移相关蛋白的翻译效率,促进乳腺癌细胞在肺部的定植和扩增,揭示了肿瘤器官选择性转移的新机制,并为靶向不同转移灶的精准干预提供了理论基础和技术支撑。
本研究成果不仅代表着靶向递送领域的一次技术飞跃,更为复杂疾病的机制解析和个体化治疗带来了崭新的解决思路。该平台具备高度可拓展性,有望在未来广泛应用于基因治疗、免疫治疗和组织再生等多个医学前沿领域。
我校EYE-X研究院特聘副研究员岳威博士为共同第一作者,北京大学第三医院李默教授、北京航空航天大学常凌乾教授、美国伊利诺伊大学香槟分校余存江教授和香港城市大学于欣格教授为本论文的共同通讯作者。
(钱中清/审 吴凤娇/文、图)